A. TÓM TẮT LÝ THUYẾT
I. Mô hình nguyên tử Rutherford – Bohr
1. Sơ lược về nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, tạo nên các chất.
Ví dụ:
+ Kim cương được cấu tạo nên từ các nguyên tử carbon.

Chú ý: Không thể quan sát nguyên tử bằng kính hiển vi quang học thông thường. Người ta sử dụng kính hiển vi điện tử với độ phóng đại lớn để quan sát nguyên tử.
2. Khái quát về mô hình nguyên tử
∎ Theo Ernest Rutherford (1871 – 1937):
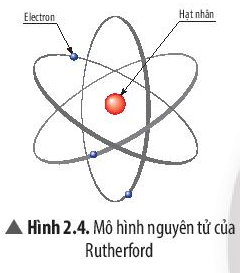 - Nguyên tử có cấu tạo gồm:
- Nguyên tử có cấu tạo gồm:
+ Vỏ tạo bởi một hay nhiều electron (kí hiệu là e), mỗi electron mang điện tích -1.
+ Hạt nhân ở bên trong chứa các hạt proton (kí hiệu là p), mỗi proton mang điện tích +1.
- Trong nguyên tử, số proton = số electron nên nguyên tử trung hòa về điện.
- Trong hạt nhân nguyên tử:
+ Điện tích hạt nhân = tổng điện tích các hạt proton.
+ Số đơn vị điện tích hạt nhân = số proton.
∎ Sau này, dựa trên mô hình của Rutherford, Niels Bohr đã phát triển một mô hình hoàn thiện hơn về nguyên tử:
- Mô hình Rutherford – Bohr: Trong nguyên tử, các electron ở vỏ được xếp thành từng lớp và chuyển động xung quanh hạt nhân theo những quỹ đạo như các hành tinh quay xung quanh Mặt Trời.
 Chú ý:
Chú ý:
Các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố thành từng lớp với số lượng electron nhất định.
+ Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron.
+ Lớp thứ hai chứa tối đa 8 electron, …
∎ Năm 1932, sau khi nghiên cứu sâu hơn về nguyên tử bằng các thiết bị tiên tiến, James Chadwick (1891 – 1974) đã phát hiện ra bên trong hạt nhân còn có hạt không mang điện, gọi là neutron.
II. Khối lượng nguyên tử
- Khối lượng nguyên tử là khối lượng của một nguyên tử, bằng tổng khối lượng các hạt (proton, neutron và electron) có trong nguyên tử.
- Tuy nhiên, khối lượng nguyên tử rất nhỏ nên để biểu thị khối lượng nguyên tử người ta sử dụng đơn vị khối lượng nguyên tử, viết tắt là amu (atomic mass unit, 1 amu = 1,6605 × 10-24 gam).
- Proton và neutron có khối lượng xấp xỉ nhau (gần bằng 1 amu); electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu). Do đó, có thể xem như khối lượng của hạt nhân là khối lượng của nguyên tử.
- Cách tính: Khối lượng nguyên tử = số proton + số neutron.
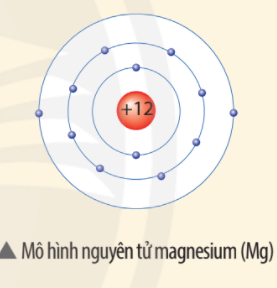
Ví dụ: Nguyên tử magnesium (Mg) trong hạt nhân có 12 proton và 12 neutron
⇒ Khối lượng nguyên tử magnesium (Mg) = 12 + 12 = 24 (amu)
B. MỞ ĐẦU
Mở đầu trang 14 Bài 2 KHTN lớp 7
Từ những vật thể đơn giản như cây bút, quyển vở, chai nước cho đến những công trình nổi tiếng như tháp Eiffel,… đều được tạo nên từ chất. Mỗi chất lại được tạo nên từ những hạt vô cùng nhỏ. Những hạt đó là gì?

Trả lời
Mỗi chất lại được tạo nên từ những hạt vô cùng nhỏ. Những hạt đó gọi là nguyên tử.
C. THẢO LUẬN
Câu hỏi thảo luận 1 trang 14 KHTN lớp 7
Những đối tượng nào trong Hình 2.1 ta có thể quan sát bằng mắt thường? Bằng kính lúp? Bằng kính hiển vi?

Trả lời
Quan sát bằng mắt thường: Ruột bút chì.
Quan sát bằng kính lúp: Hạt bụi trong không khí.
Quan sát bằng kính hiển vi: Tế bào máu, vi khuẩn.
Câu hỏi thảo luận 2 trang 14 KHTN lớp 7
Quan sát Hình 2.2, em hãy cho biết khí oxygen, sắt, than chì có đặc điểm chung gì về cấu tạo?
Trả lời
Khí oxygen, sắt, than chì đều được tạo nên từ những hạt vô cùng nhỏ, gọi là nguyên tử.
Câu hỏi thảo luận 3 trang 15 KHTN lớp 7
Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào?
Trả lời
Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm hạt nhân ở bên trong và lớp vỏ tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm. Bên trong hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương.
Các electron được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân theo quỹ đạo tương tự như hành tinh trong hệ Mặt Trời.
Câu hỏi thảo luận 4 trang 15 KHTN lớp 7
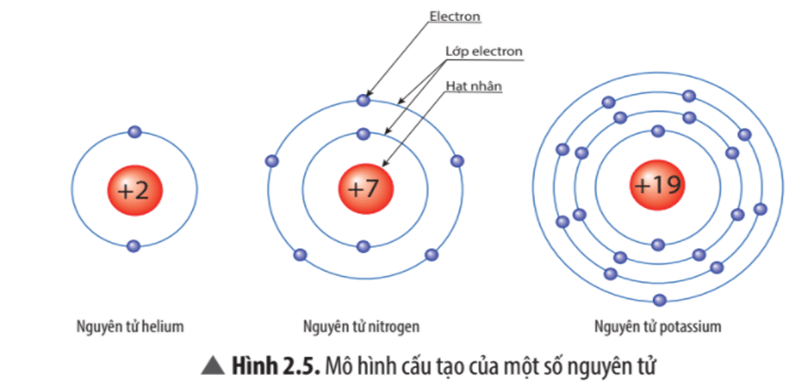
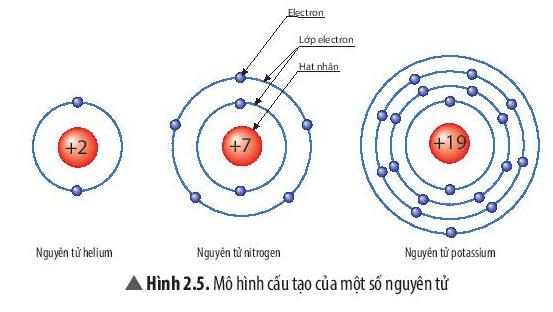
Quan sát Hình 2.5, hãy cho biết nguyên tử nitrogen và potassium có bao nhiêu:
a) điện tích hạt nhân nguyên tử?
b) lớp electron?
c) electron trên mỗi lớp?
Trả lời
| Nguyên tử nitrogen | Nguyên tử potassium |
Điện tích hạt nhân nguyên tử | +7 | +19 |
Lớp electron | 2 | 4 |
Electron trên mỗi lớp | 2/5 | 2/8/8/1 |
Câu hỏi thảo luận 5 trang 16 KHTN lớp 7
Tại sao nguyên tử trung hòa về điện?
Trả lời
Mỗi electron mang điện tích -1, mỗi proton mang điện tích +1, mà trong nguyên tử, số hạt proton và electron luôn bằng nhau do đó nguyên tử trung hòa về điện.
Câu hỏi thảo luận 6 trang 17 KHTN lớp 7
Vì sao người ta thường sử dụng amu làm đơn vị khối lượng nguyên tử?
Trả lời
Khối lượng của nguyên tử rất nhỏ, không thể cân đo dễ dàng bằng các dụng cụ bình thường (theo khối lượng g hay kg), bên cạnh đó phải sử dụng số mũ, lũy thừa âm lớn cho các đơn vị g hay kg nên không thuận tiện.Vì thế để biểu thị khối lượng nguyên tử người ta sử dụng đơn vị khối lượng nguyên tử, viết tắt là amu (atomic mass unit).
1 amu = 1,6605 × 10-24 gam
D. LUYỆN TẬP
Luyện tập 1 trang 16 KHTN lớp 7
Cho biết các thành phần cấu tạo nên nguyên tử trong hình minh họa sau:
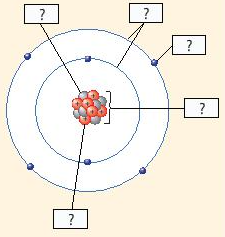
Trả lời
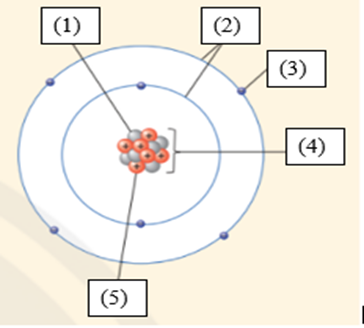
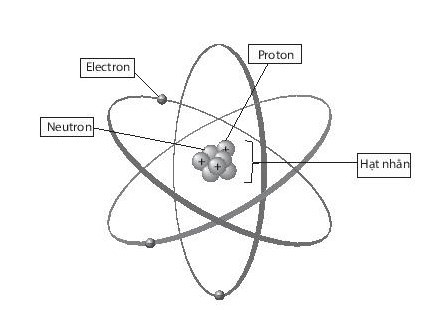
(1) Neutron
(2) Vỏ nguyên tử
(3) Electron
(4) Hạt nhân nguyên tử
(5) Proton
Luyện tập 2 trang 16 KHTN lớp 7
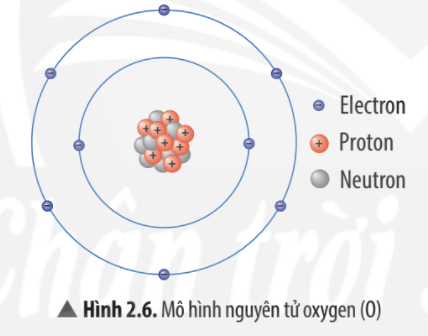
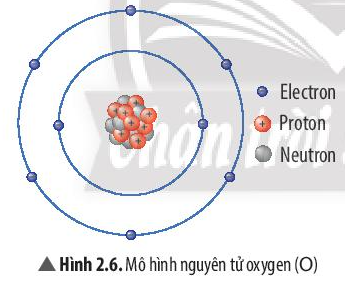
Quan sát Hình 2.6, hãy hoàn thành bảng sau:
Số đơn vị điện tích hạt nhân | Số proton | Số electron trong nguyên tử | Số electron ở lớp ngoài cùng |
Để lớp electron ngoài cùng của nguyên tử oxygen có đủ số electron tối đa thì cần thêm bao nhiêu electron nữa?
Trả lời
Số đơn vị điện tích hạt nhân | Số proton | Số electron trong nguyên tử | Số electron ở lớp ngoài cùng |
8 | 8 | 8 | 6 |
Để lớp electron ngoài cùng của nguyên tử oxygen có đủ số electron tối đa là 8 thì cần thêm 2 electron nữa.
Luyện tập trang 17 KHTN lớp 7
Quan sát mô hình dưới đây, cho biết số proton, số electron và xác định khối lượng nguyên tử magnesium (biết số neutron bằng 12).
Trả lời
Điện tích hạt nhân nguyên tử Mg là +12.
⇒ Một nguyên tử magnesium (Mg) gồm: 12 proton, 12 electron.
Khối lượng nguyên tử Mg bằng 12 + 12 = 24 amu.
(do khối lượng 1p = 1n = 1 amu).
E. BÀI TẬP
Bài 1 trang 17 KHTN lớp 7
Em hãy điền vào chỗ trống các từ, cụm từ thích hợp sau để được câu hoàn chỉnh:
chuyển động | các electron | hạt nhân | điện tích dương | trung hòa về điện |
vỏ nguyên tử | điện tích âm | vô cùng nhỏ | sắp xếp |
|
Nguyên tử là hạt (1) … và (2) … Theo Rutherford – Bohr, nguyên tử có cấu tạo gồm 2 phần là (3) … (mang (4) …) và (5) … tạo bởi (6) … (mang (7) …).
Trong nguyên tử, các electron (8) … xung quanh hạt nhân và (9) … thành từng lớp.
Trả lời
(1) vô cùng nhỏ
(2) trung hòa về điện
(3) hạt nhân
(4) điện tích dương
(5) vỏ nguyên tử
(6) các electron
(7) điện tích âm
(8) chuyển động
(9) sắp xếp
Bài 2 trang 17 KHTN lớp 7
Vì sao nói khối lượng hạt nhân được coi là khối lượng nguyên tử?
Trả lời
Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu).
Electron có khối lượng rất bé (chỉ khoảng bằng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron.
Do đó khối lượng hạt nhân được coi là khối lượng nguyên tử.
SÁCH BÀI TẬP
Bài 2.1 trang 6 SBT Khoa học tự nhiên 7: Có những hạt nào được tìm thấy trong hạt nhân của nguyên tử?
A. Các hạt mang điện tích âm (electron).
B. Các hạt neutron và hạt proton.
C. Các hạt neutron không mang điện.
D. Hạt nhân nguyên tử không chứa hạt nào bên trong.
Lời giải:
Đáp án đúng là: B
Các hạt neutron và hạt proton được tìm thấy trong hạt nhân nguyên tử.
Bài 2.2 trang 6 SBT Khoa học tự nhiên 7: Điều nào sau đây mô tả đầy đủ thông tin nhất về proton?
A. Proton là một hạt vô cùng nhỏ và mang điện tích âm.
B. Proton là hạt mang điện tích dương và được phát hiện trong hạt nhân nguyên tử.
C. Proton là hạt không mang điện và được tìm thấy trong hạt nhân nguyên tử.
D. Proton là một hạt vô cùng nhỏ, mang điện tích dương và được tìm thấy trong hạt nhân nguyên tử.
Lời giải:
Đáp án đúng là: D
Proton là một hạt vô cùng nhỏ, mang điện tích dương và được tìm thấy trong hạt nhân nguyên tử.
Bài 2.3 trang 6 SBT Khoa học tự nhiên 7: Một đơn vị khối lượng nguyên tử (1amu) theo định nghĩa có giá trị bằng
A. 1/16 khối lượng của nguyên tử oxygen.
B. 1/32 khối lượng của nguyên tử sulfur.
C. 1/12 khối lượng của nguyên tử carbon.
D. 1/10 khối lượng của nguyên tử boron.
Lời giải:
Đáp án đúng là: C
Một đơn vị khối lượng nguyên tử (1amu) theo định nghĩa có giá trị bằng 1/12 khối lượng của nguyên tử carbon.
Bài 2.4 trang 6 SBT Khoa học tự nhiên 7: Trong các nguyên tử sau, nguyên tử nào có khối lượng nguyên tử lớn nhất?
A. Na.
B. O.
C. Ca.
D. H.
Lời giải:
Đáp án đúng là: C
Khối lượng nguyên tử Na là 23 amu.
Khối lượng nguyên tử O là 16 amu.
Khối lượng nguyên tử Ca là 40 amu.
Khối lượng nguyên tử H là 1 amu.
Vậy khối lượng nguyên tử Ca là lớn nhất.
Bài 2.5 trang 6 SBT Khoa học tự nhiên 7: Khối lượng của các hạt dưới nguyên tử (proton, neutron) được đo bằng đơn vị
A. gam.
B. amu.
C. mL.
D. kg.
Lời giải:
Đáp án đúng là: B
Khối lượng của các hạt dưới nguyên tử (proton, neutron) được đo bằng đơn vị amu.
Bài 2.6 trang 6 SBT Khoa học tự nhiên 7: Chú thích cấu tạo nguyên tử trong hình sau:
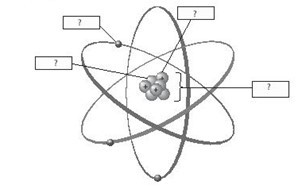
Lời giải:
Bài 2.7 trang 7 SBT Khoa học tự nhiên 7: Hoàn thành bảng sau:

Lời giải:

Bài 2.8 trang 7 SBT Khoa học tự nhiên 7: Điền từ thích hợp vào chỗ trống:
nguyên tử; neutron; electron; proton; lớp vỏ electron; hạt nhân
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) …….. Nguyên tử được tạo nên từ (2) ……….và (3) ………….
b) (4) …………..nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) …………. và (6) …………
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) ………. và các hạt không mang điện tích được gọi là (8) ………….
d) (9) ………… chuyển động quanh hạt nhân nguyên tử.
Lời giải:
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) nguyên tử. Nguyên tử được tạo nên từ (2) hạt nhân và (3) lớp vỏ electron.
b) (4) Hạt nhân nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) proton và (6) neutron.
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) proton và các hạt không mang điện tích được gọi là (8) neutron.
d) (9) Electron chuyển động quanh hạt nhân nguyên tử.
Bài 2.9 trang 7 SBT Khoa học tự nhiên 7: Quan sát hình dưới đây và trả lời các câu hỏi sau:
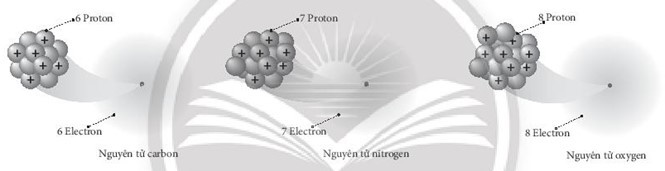
a) Số hạt proton trong các nguyên tử có trong hình trên là bao nhiêu hạt?
b) Các nguyên tử khác nhau sẽ có số hạt nào khác nhau?
c) Vì sao mỗi nguyên tử không mang điện?
Lời giải:
a) Số hạt proton trong các nguyên tử có trong hình trên:
- Nguyên tử carbon có 6 hạt proton.
- Nguyên tử nitrogen có 7 hạt proton.
- Nguyên tử oxygen có 8 hạt proton.
b) Các nguyên tử khác nhau sẽ có số hạt proton khác nhau.
c) Trong mỗi nguyên tử, số proton mang điện tích dương luôn bằng với số electron mang điện tích âm nên nguyên tử trung hòa về điện, do đó nguyên tử không mang điện.
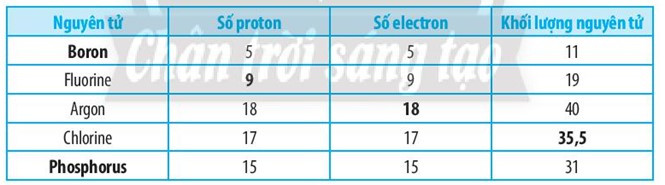
Bài 2.10 trang 7 SBT Khoa học tự nhiên 7: Hoàn thành bảng sau:
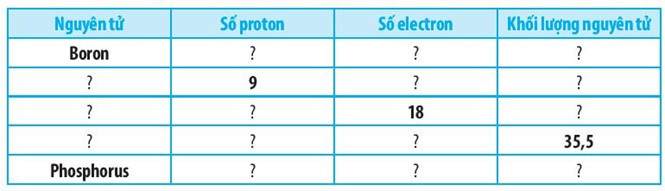
Lời giải:
Bài 2.11 trang 7 SBT Khoa học tự nhiên 7: Em hãy tìm hiểu trên Internet hoặc sách, báo, tài liệu, … về lịch sử tìm ra nguyên tử. Viết một đoạn văn ngắn khoảng 200 từ để tóm tắt những đóng góp của các nhà khoa học cho việc tìm ra nguyên tử.
Lời giải:
Học sinh tham khảo gợi ý sau:
Vào khoảng năm 440 trước Công Nguyên, nhà triết học Đê – mô – crit cho rằng đồng tiền bạc bị chia nhỏ mãi, sau cùng sẽ được một loại hạt “không thể phân chia được nữa”, gọi là nguyên tử. Cho đến tận giữa thế kỉ XIX, người ta cho rằng: Các chất đều được tạo nên từ những hạt cực kì nhỏ bé không thể phân chia được nữa gọi là nguyên tử. Những công trình thực nghiệm vào cuối thế kỉ XIX, đầu thể kỉ XX đã chứng minh nguyên tử có thật và có cấu trúc phức tạp. Cụ thể:
Năm 1897, J.J. Thomson, nhà bác học người Anh, khi nghiên cứu hiện tượng phóng điện trong chân không đã phát hiện ra tia âm cực, mà bản chất là các hạt nhỏ bé, mang điện tích âm gọi là các electron.
Năm 1911, E. Rutherford và các cộng sự đã cho các hạt alpha (α) bắn phá một lá vàng mỏng và khám phá ra hạt nhân nguyên tử.
Năm 1918, E. Rutherford khi bắn phá hạt nhân nguyên tử nitrogen bằng hạt alpha đã tìm ra proton.
Năm 1932, J. Chadwick dùng hạt alpha bắn phá hạt nhân nguyên tử beryllium đã tìm ra neutron.
Bài 2.12 trang 7 SBT Khoa học tự nhiên 7: Vì sao trong tự nhiên chỉ có 98 loại nguyên tử nhưng lại có hàng triệu chất khác nhau?
Lời giải:
Trong tự nhiên chỉ có 98 loại nguyên tử nhưng lại có hàng triệu chất khác nhau vì:
+ Các nguyên tử có thể liên kết với nhau để tạo thành một chất khác.
+ Các chất có thể phản ứng với nhau để tạo thành chất mới.