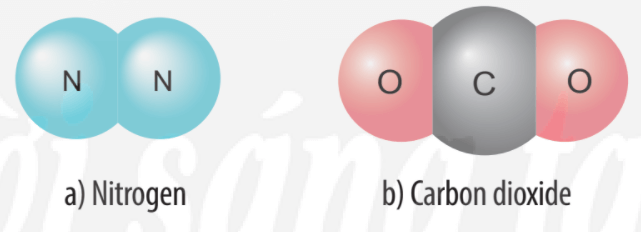TÓM TẮT LÝ THUYẾT
I. Vỏ nguyên tử khí hiếm
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hóa học kém.
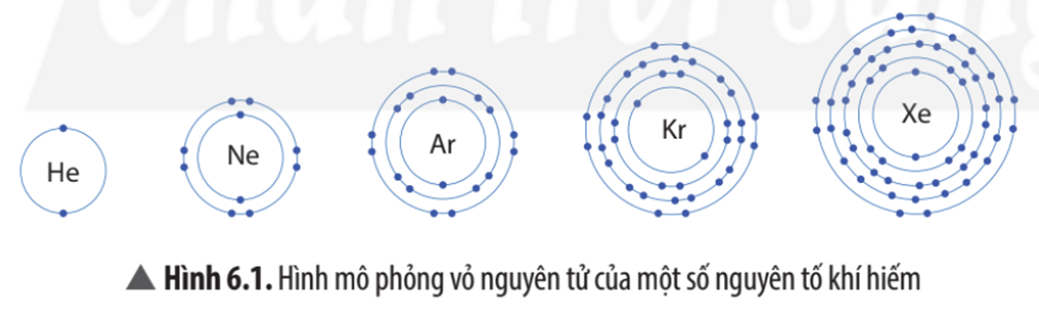
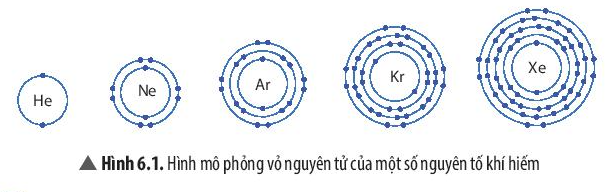
Nhóm khí hiếm gồm: helium (He); neon (Ne); argon (Ar); krypton (Kr); xenon (Xe), …
Chú ý:
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng nhường hoặc nhận hoặc góp chung electron.
+ Nguyên tử của các nguyên tố kim loại thường có khuynh hướng nhường electron ở lớp ngoài cùng.
+ Nguyên tử của các nguyên tố phi kim thường có khuynh hướng nhận thêm hoặc góp chung electron để có lớp electron ngoài cùng bền vững.
II. Liên kết ion
1. Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương tương ứng.
Ví dụ: Nguyên tử magnesium nhường 2 electron lớp ngoài cùng tạo thành ion magnesium. Ion magnesium là ion dương, có 8 electron lớp ngoài cùng, cấu hình electron giống với khí hiếm Ne.
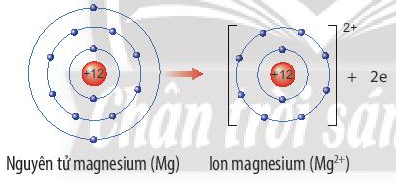
Hay viết gọn: Mg → Mg2+ + 2e
2. Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim (Cl, O, N …) có số electron lớp ngoài cùng là 7, 6, 5, … nên khi kết hợp với các nguyên tử kim loại, nguyên tử phi kim có xu hướng nhận electron từ nguyên tử kim loại để có lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng.
Ví dụ: Nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng tạo thành ion oxygen. Ion oxygen có 8 electron lớp ngoài cùng, cấu hình electron giống với nguyên tử khí hiếm Ne.
 Hay viết gọn: O + 2e → O2-
Hay viết gọn: O + 2e → O2-
3. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên tử kim loại nhường electron tạo thành ion dương, đồng thời nguyên tử phi kim nhận electron tạo thành ion âm.
- Ion âm và ion dương mang điện tích trái dấu, hút nhau, tạo thành liên kết ion.
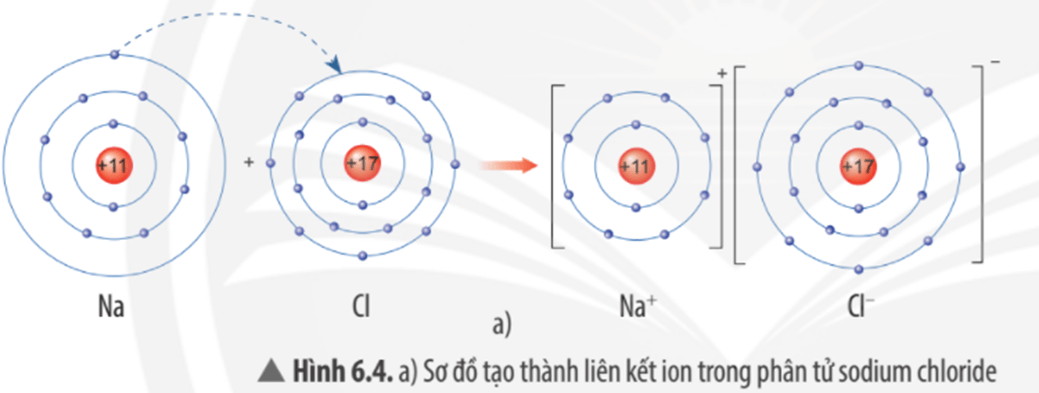
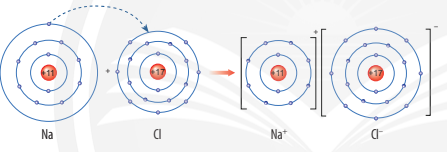
Ví dụ 1: Sơ đồ tạo thành liên kết ion trong phân tử NaCl (sodium chloride).
Nguyên tử sodium nhường 1 electron tạo thành ion sodium (điện tích dương), nguyên tử chlorine nhận 1 electron tạo thành ion chlorine (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử sodium chlorine.
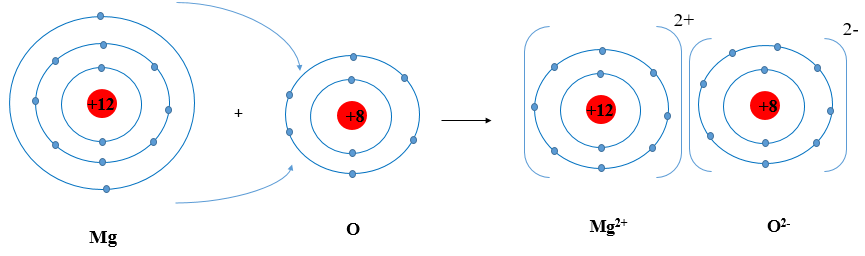
 Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
Nguyên tử magnesium nhường 2 electron tạo thành ion magnesium (điện tích dương), nguyên tử oxygen nhận 2 electron tạo thành ion oxygen (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử magnesium oxide
Kết luận:
- Liên kết ion là liên kết giữa ion dương và ion âm.
- Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
III. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim với phi kim.
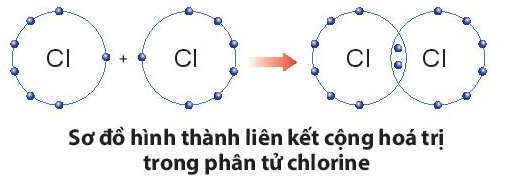
Ví dụ 1: Quá trình tạo thành liên kết cộng hóa trị trong phân tử chlorine:
+ Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
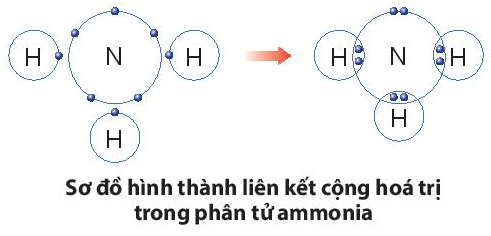
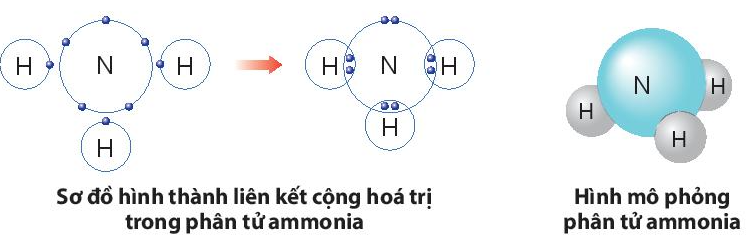
 Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
+ Nitrogen thuộc nhóm VA, có 5 electron lớp ngoài cùng, nguyên tử nitrogen sẽ góp chung 3 electron.
+ Hydrogen thuộc nhóm IA, có 1 electron lớp ngoài cùng, mỗi nguyên tử hydrogen sẽ góp chung 1 electron, theo sơ đồ sau:
IV. Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
Ví dụ một số hợp chất ion:

- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
Ví dụ một số hợp chất cộng hóa trị:

- Ở điều kiện thường, chất ion thường ở thể rắn, chất cộng hóa trị ở thể rắn, thể lỏng hoặc thể khí.
V. Một số tính chất của chất ion và chất cộng hóa trị
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện.
- Chất cộng hóa trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
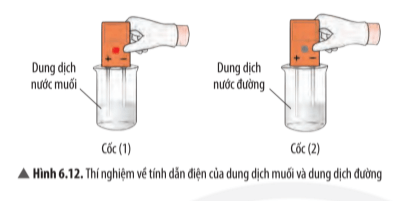
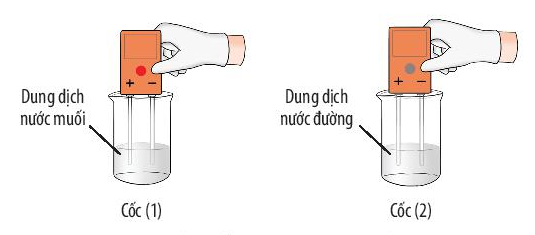
- Ví dụ 1: Dung dịch nước muối dẫn điện còn dung dịch nước đường thì không dẫn điện.
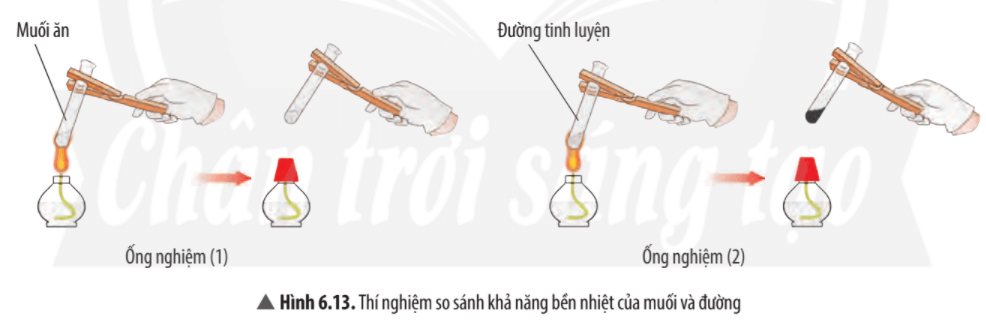
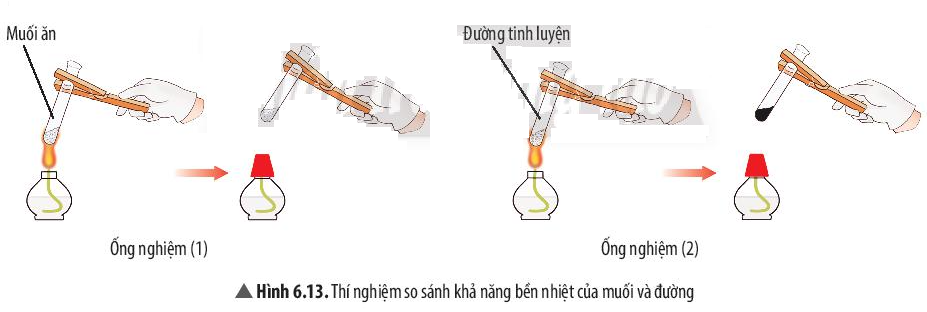
 Ví dụ 2: Đường nóng chảy và biến đổi thành chất khác có màu đen. Muối ăn không bị nóng chảy.
Ví dụ 2: Đường nóng chảy và biến đổi thành chất khác có màu đen. Muối ăn không bị nóng chảy.
CÂU HỎI SÁCH GIÁO KHOA
Mở đầu trang 37 Bài 6 KHTN lớp 7
Ở điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập, trong khi các nguyên tử của nguyên tố khác lại có xu hướng kết hợp với nhau.
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?
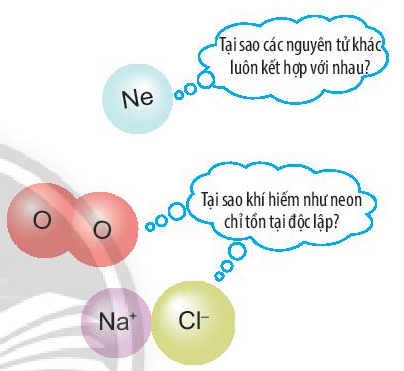
Trả lời:
Các nguyên tử của nguyên tố có xu hướng kết hợp với nhau để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm.
1. Vỏ nguyên tử khí hiếm
Câu hỏi thảo luận 1 trang 37 Khoa học tự nhiên 7
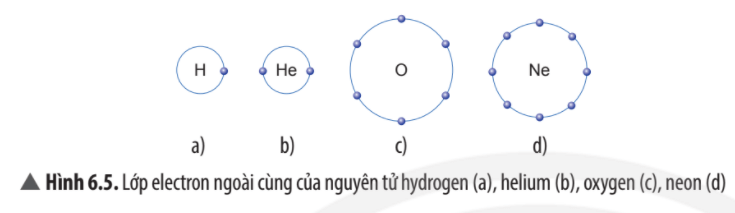
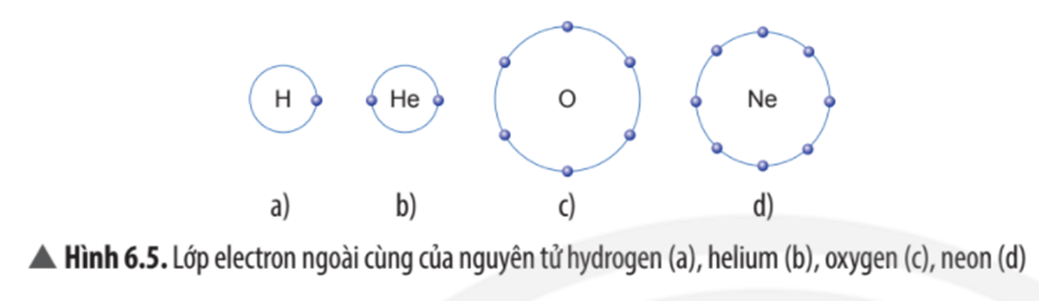
Trừ helium, vỏ nguyên tử của các nguyên tố còn lại ở Hình 6.1 có những điểm giống và khác nhau gì?
Trả lời:
Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
2. Liên kết ion
Câu hỏi thảo luận 2 trang 38 KHTN lớp 7
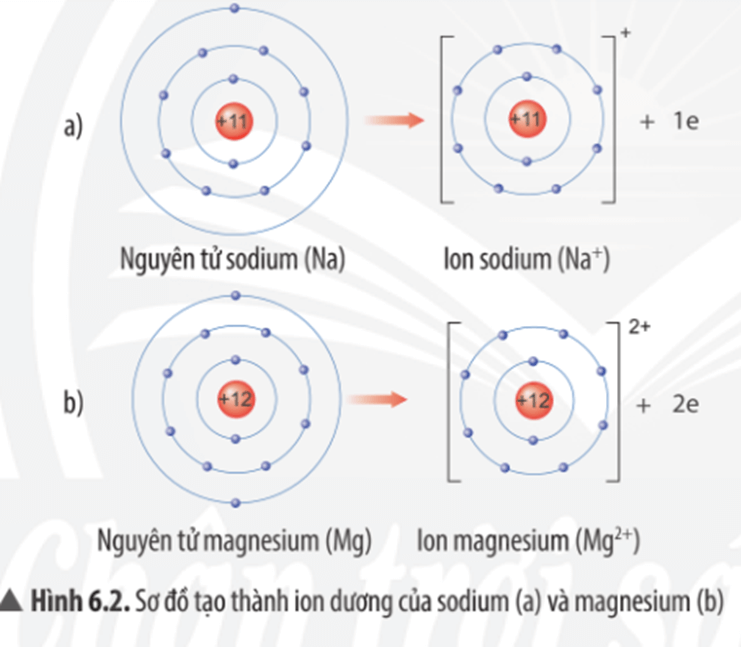
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời:
Mô tả sự tạo thành ion sodium, ion magnesium:
- Nguyên tử sodium (Na) nhường đi 1 electron ở lớp vỏ ngoài cùng để trở thành ion sodium mang điện tích dương, kí hiệu Na+.
- Nguyên tử magnesium (Mg) nhường đi 2 electron ở lớp vỏ ngoài cùng để trở thành ion magnesium mang điện tích dương, kí hiệu Mg2+.
Nhận xét:
- Các ion này đều có 8 electron lớp ngoài cùng.
- Sự phân bố electron của ion sodium (Na+) và ion magnesium (Mg2+) đều giống với sự phân bố electron của nguyên tử khí hiếm neon (Ne).

Luyện tập trang 38 KHTN lớp 7
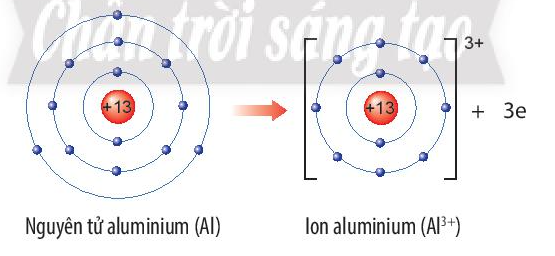
Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium.
Trả lời:
Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+.
Sơ đồ tạo thành ion aluminium:
Câu hỏi thảo luận 3 trang 38 KHTN lớp 7
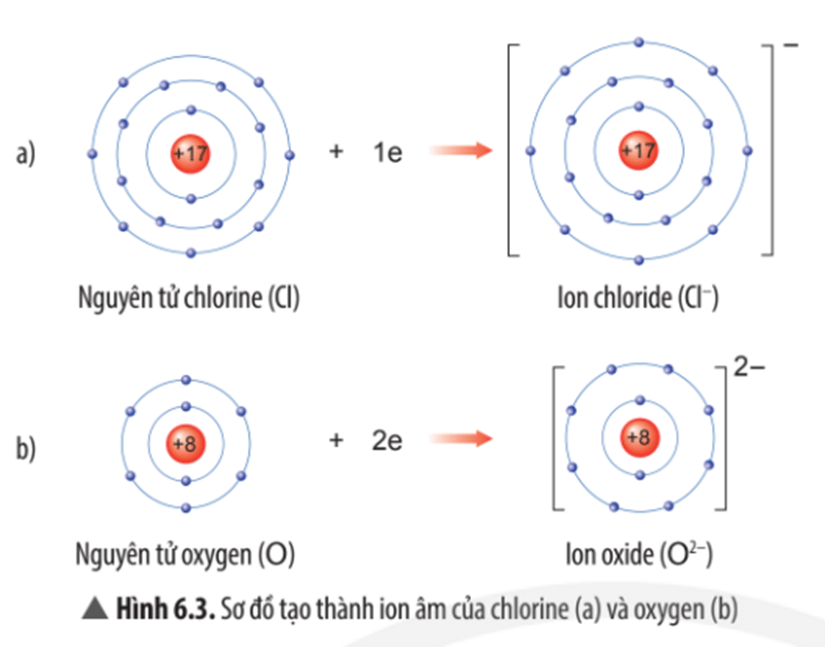
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời:
Mô tả sự tạo thành ion chloride, ion oxide:
- Nguyên tử chlorine nhận thêm 1 electron vào lớp electron ngoài cùng để trở thành ion chloride mang điện tích âm, kí hiệu Cl-;
- Nguyên tử oxygen nhận thêm 2 electron vào lớp electron ngoài cùng để trở thành ion oxide mang điện tích âm, kí hiệu O2-.
Nhận xét:
- Lớp vỏ của các ion chloride và ion oxide đều có 8 electron lớp ngoài cùng.
- Sự phân bố electron của ion chloride giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).


Luyện tập trang 39 KHTN lớp 7
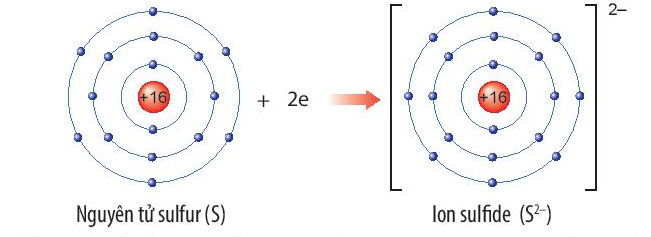
Xác định vị trí của sulfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sulfide (S2-) từ nguyên tử sulfur.
Trả lời:
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).
Câu hỏi thảo luận 4 trang 39 KHTN lớp 7
Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Nêu một số ứng dụng của sodium chloride trong đời sống.
Trả lời:
Mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride:
Khi nguyên tử sodium (Na) kết hợp với nguyên tử chlorine (Cl), nguyên tử Na nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử Cl nhận 1 electron từ nguyên tử Na tạo thành ion âm, kí hiệu Cl-. Ion Na+ và Cl- hút nhau tạo phân tử sodium chloride (NaCl).
Một số ứng dụng của sodium chloride trong đời sống:
- Trong công nghiệp:
+ Sodium chloride dùng sản xuất giấy, thuốc nhuộm;…
+ Sử dụng trong công nghiệp dệt may và sản xuất vải, sản xuất xà phòng, chất tẩy rửa.
+ Nguyên liệu ban đầu để sản xuất chlorine và xút.
+ Trong công nghiệp sản xuất giày da, người ta sử dụng sodium chloride để bảo vệ da.
+ Trong sản xuất cao su, sodium chloride được dùng để làm trắng các loại cao su.
+ Trong dầu khí, sodium chloride là thành phần quan trọng trong dung dịch khoan giếng.
+ Từ sodium chloride có thể chế ra các loại hóa chất dùng trong các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javen, … bằng cách điện phân nóng chảy hoặc điện phân dung dịch sodium chloride có màng ngăn.
- Trong nông nghiệp và trong đời sống:
+ Giúp cân bằng sinh lí trong cơ thể con người, gia súc, gia cầm, …
+ Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón;
+ Sodium chloride có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu khiến vi khuẩn mất nước và chết.
+ Sodium chloride dùng để ướp thực phẩm tươi sống như tôm, cá, … để không bị ươn, ôi trước khi thực phẩm được nấu, vận chuyển đi xa, …
- Trong y tế:
+ Sát trùng vết thương;
+ Pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh;
+ Cung cấp muối khoáng cho cơ thể;
+ Khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, hôi miệng …
Luyện tập trang 39 KHTN lớp 7
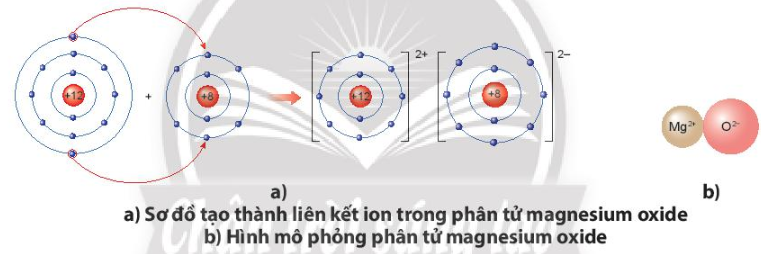
Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide.
Trả lời:
Khi nguyên tử magnesium (Mg) kết hợp với nguyên tử oxygen (O), nguyên tử magnesium nhường 2 electron tạo thành ion magnesium, mang điện tích dương, kí hiệu là Mg2+, đồng thời nguyên tử oxygen (O) nhận 2 electron từ nguyên tử Mg tạo thành ion oxide, mang điện tích âm, kí hiệu O2-. Ion Mg2+ và O2- hút nhau tạo phân tử magnesium oxide (MgO).
Vận dụng trang 39 KHTN lớp 7
Calcium chloride có nhiều ứng dụng trong đời sống. Tìm hiểu qua sách báo và internet, em hãy cho biết một số ứng dụng của chất này. Vẽ sơ đồ tạo thành liên kết trong phân tử calcium chloride.

Trả lời:
Sơ đồ tạo thành liên kết trong phân tử calcium chloride:
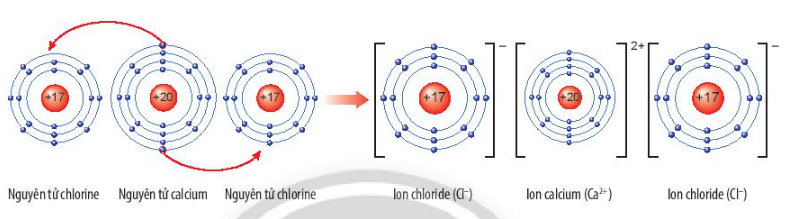
Ứng dụng của CaCl2:
- Dùng để làm khô trong quy trình chế biến thực phẩm đóng hộp và các loại tinh bột;
- Làm chất chống đóng băng trên mặt đường ở những quốc gia ôn đới hoặc làm chất chống diệt bụi, nấm mốc.
- Trong xây dựng, calcium chloride là chất làm tăng thời gian đông của bê tông.
- Trong công nghiệp luyện kim và sản xuất giấy, chất này đóng vai trò là chất phụ gia trong quá trình tải nhiệt và làm khô.
- Calcium chloride được ứng dụng trong hệ thống tiêu nước và xử lý nước thải công nghiệp;
- Là chất hỗ trợ giúp hút oxygen trong không khí, được ứng dụng làm thiết bị cứu hỏa.
3. Liên kết cộng hóa trị
Câu hỏi thảo luận 5 trang 40 KHTN lớp 7
Dựa vào bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của hydrogen và oxygen. Để có lớp electron ngoài cùng giống nguyên tố khí hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì?
Trả lời:
Nguyên tố khí hiếm gần nhất của hydrogen là helium (He).
Nguyên tử hydrogen có 1 electron lớp ngoài cùng, để có lớp electron ngoài cùng giống nguyên tố helium (2 electron lớp ngoài cùng) nguyên tử hydrogen có xu hướng thêm 1 electron.
Nguyên tố khí hiếm gần nhất của oxygen là neon (Ne).
Nguyên tử oxygen có 6 electron lớp ngoài cùng, để có lớp electron ngoài cùng giống nguyên tố neon (8 electron lớp ngoài cùng) nguyên tử oxygen có xu hướng thêm 2 electron.
Câu hỏi thảo luận 6 trang 40 KHTN lớp 7
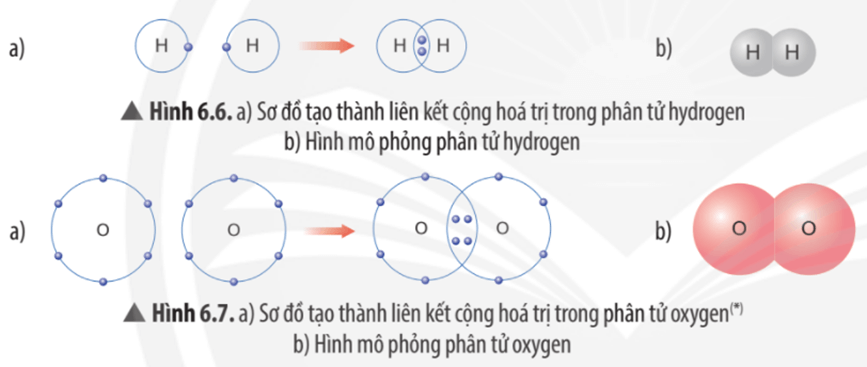
Dựa vào các Hình 6.5, 6.6 và 6.7, em hãy cho biết số electron lớp ngoài cùng của mỗi nguyên tử trong phân tử hydrogen và oxygen là bao nhiêu?
Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen và nguyên tử oxygen sẽ giống với khí hiếm nào?
Trả lời:
- Trong phân tử hydrogen (H2), mỗi nguyên tử hydrogen (H) đều có 2 electron ở lớp ngoài cùng. Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen giống với khí hiếm helium (He)
- Trong phân tử oxygen (O2), mỗi nguyên tử oxygen (O) đều có 8 electron ở lớp ngoài cùng. Khi đó, lớp electron ngoài cùng của nguyên tử oxygen giống với khí hiếm neon (Ne).
Câu hỏi thảo luận 7 trang 40 KHTN lớp 7
Em hãy mô tả quá trình tạo thành liên kết cộng hóa trị trong phân tử hydrogen và oxygen.
Trả lời:
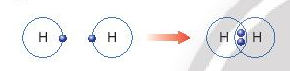
- Quá trình tạo thành liên kết cộng hóa trị trong phân tử hydrogen:
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp chung 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử hydrogen.
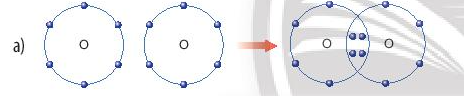
- Quá trình tạo thành liên kết cộng hóa trị trong phân tử oxygen:
+ Nguyên tử O có 6 electron lớp ngoài cùng, cần thêm 2 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử O liên kết với nhau, mỗi nguyên tử góp 2 electron để tạo ra hai cặp electron dùng chung.
+ Hạt nhân của hai nguyên tử O cùng hút các cặp electron dùng chung và liên kết với nhau tạo thành phân tử oxygen.
Câu hỏi thảo luận 8 trang 41 KHTN lớp 7
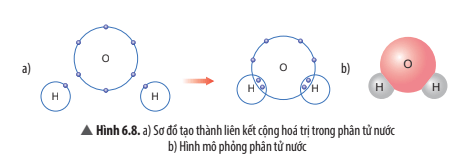
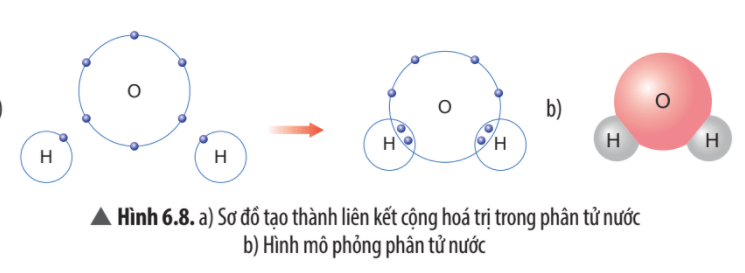
Quan sát Hình 6.8, em hãy cho biết số electron dùng chung của nguyên tử H và nguyên tử O. Trong phân tử nước, số electron ở lớp ngoài cùng của O và H là bao nhiêu và giống với khí hiếm nào?
Trả lời:
- Mỗi nguyên tử H góp chung 1 electron, nguyên tử O góp chung 1 electron với mỗi nguyên tử H. Trong phân tử nước có 2 nguyên tử H, vậy nguyên tử O góp chung 2 electron với 2 nguyên tử H.
- Trong phân tử nước, số electron ở lớp ngoài cùng của O là 8 electron giống với khí hiếm neon (Ne).
Trong phân tử nước, số electron ở lớp ngoài cùng của H là 2 electron giống với khí hiếm helium (He),
Câu hỏi thảo luận 9 trang 41 KHTN lớp 7
Em hãy mô tả quá trình tạo thành liên kết cộng hóa trị trong phân tử nước.
Trả lời:
Khi tạo thành phân tử nước, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. Như vậy, giữa nguyên tử O và nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
Luyện tập trang 41 KHTN lớp 7
Vẽ sơ đồ hình thành liên kết cộng hóa trị trong các phân tử sau
Trả lời:
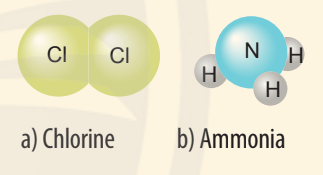
a) Sự hình thành liên kết trong phân tử chlorine:
- Nguyên tử Cl có 7 electron lớp ngoài cùng, cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
- Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
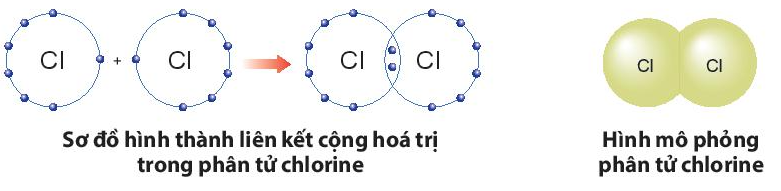
b) Sự hình thành liên kết trong phân tử ammonia:
- Nguyên tử N có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi tạo thành phân tử NH3, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
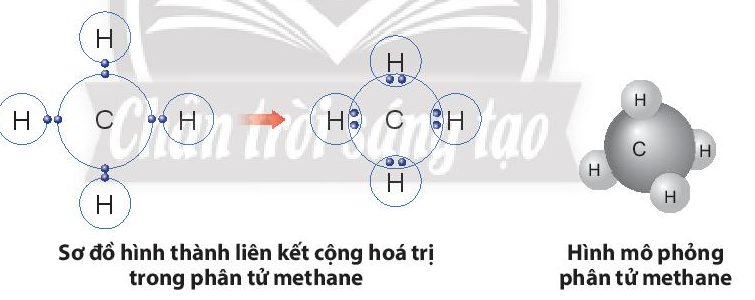
Vận dụng trang 41 KHTN lớp 7
Khí methane là thành phần chính của khí thiên nhiên và khí mỏ dầu. Khí này còn được tạo ra từ hầm biogas. Methane là nguồn nhiên liệu quan trọng trong đời sống và có nhiều ứng dụng trong công nghiệp. Em hãy vẽ sơ đồ hình thành liên kết trong phân tử methane và liệt kê một số ứng dụng của nó thông qua tìm hiểu trên sách báo, internet, …
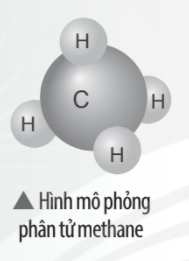
Trả lời:
Sự hình thành liên kết trong phân tử methane:
- Nguyên tử C có 4 electron lớp ngoài cùng, cần thêm 4 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi C kết hợp với H, nguyên tử C góp 4 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử C và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử C và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử methane.
- Ứng dụng của methane:
+ Làm nhiên liệu đun nấu thay cho các nhiên liệu khác, thắp sáng.
+ Trong công nghiệp: dùng trong nhiều phản ứng hóa công nghiệp; làm nguyên liệu sản xuất hydrogen, methanol, acetic acid và acetic anhydride.
4. Chất ion, chất cộng hóa trị
Câu hỏi thảo luận 10 trang 41 KHTN lớp 7
Cho biết mỗi phân tử của chất trong Hình 6.9 được tạo bởi các ion nào? Ở điều kiện thường, các chất này ở thể gì?

Trả lời:
Hình 6.9 a) Phân tử sodium chloride (NaCl) được tạo bởi ion Na+ và Cl-;
Hình 6.9 b) Phân tử calcium chloride (CaCl2) được tạo bởi ion Ca2+ và Cl-;
Hình 6.9 c) Phân tử magnesium oxide (MgO) được tạo bởi ion Mg2+ và O2-;
Ở điều kiện thường, các chất này đều tồn tại ở thể rắn.
Câu hỏi thảo luận 11 trang 42 KHTN lớp 7
Quan sát và cho biết thể của các chất có trong Hình 6.10.
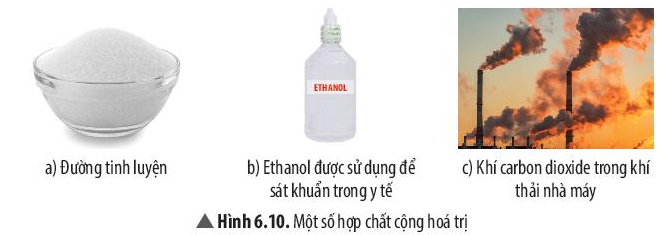
Trả lời:
- Hình 6.10 a) Đường tinh luyện ở thể rắn.
- Hình 6.10 b) Ethanol ở thể lỏng.
- Hình 6.10 c) Carbon dioxide ở thể khí.
Câu hỏi thảo luận 12 trang 42 KHTN lớp 7
Nêu một số ví dụ về chất cộng hóa trị và cho biết thể của chúng ở điều kiện thường.
Trả lời:
- Thể rắn: iodine, nước đá khô, …
- Thể lỏng: nước; ethanol; bromine …
- Thể khí: nitrogen; chlorine; sulfur dioxide …
Luyện tập trang 42 KHTN lớp 7
Khói của núi lửa ngầm phun trào từ dưới biển có chứa một số chất như: hơi nước, sodium chloride, potassium chloride, carbon dioxide, sulfur dioxide.
a) Hãy cho biết chất nào là hợp chất ion, chất nào là hợp chất cộng hóa trị.
b) Nguyên tử của nguyên tố nào trong các chất trên có số electron ở lớp ngoài cùng nhiều nhất?

Trả lời:
a) Chất ion: sodium chloride (NaCl), potassium chloride (KCl);
Chất cộng hóa trị: hơi nước (H2O), carbon dioxide (CO2), sulfur dioxide (SO2).
b) Trong các chất trên nguyên tử của chlorine (Cl) có số electron ở lớp ngoài cùng nhiều nhất với 7 electron.
5. Một số tính chất của chất ion và chất cộng hóa trị
Câu hỏi thảo luận 13 trang 42 KHTN lớp 7
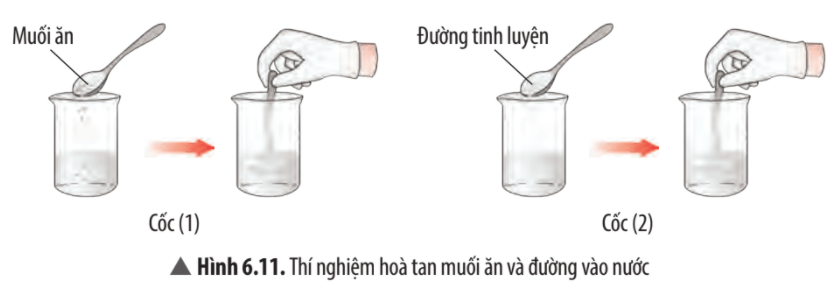
Quan sát thí nghiệm 1 (Hình 6.11, 6.12) và đánh dấu để hoàn thành bảng sau:
Trả lời:
Tính chất | Muối | Đường |
Tan trong nước | √ | √ |
Dẫn điện được | √ |
|
Câu hỏi thảo luận 14 trang 43 KHTN lớp 7
Quan sát thí nghiệm 2 (Hình 6.13), cho biết muối hay đường bền nhiệt hơn. Ở ống nghiệm nào có sự tạo thành chất mới?
Trả lời:
Quan sát thí nghiệm ta thấy muối ăn không bị nhiệt phân hủy (không bị biến đổi khi đun), đường bị nhiệt phân hủy thành chất mới có màu đen.
⇒ Muối ăn bền với nhiệt hơn đường.
Mở rộng: Đường nóng chảy ở 186oC, muối ăn (sodium chloride) nóng chảy ở 810oC. Ở thí nghiệm này nếu tăng thêm thời gian đun nóng, muối rắn sẽ nóng chảy ra thành lỏng. Tính chất này vẫn là tính chất vật lí.
Luyện tập trang 44 KHTN lớp 7
Kết quả thử nghiệm tính chất của 2 chất A và B được trình bày ở bảng bên. Em hãy cho biết chất nào là chất cộng hóa trị, chất nào là chất ion?
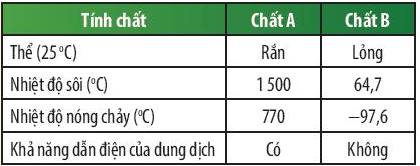
Trả lời:
Dựa vào kết quả được trình bày ở bảng trên ta thấy:
Chất A có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn rất nhiều so với chất B, chất A tồn tại ở thể rắn và dung dịch chất A có khả năng dẫn điện, dung dịch chất B không có khả năng dẫn điện.
⇒ Chất A là hợp chất ion, chất B là chất cộng hóa trị.
Dự đoán chất A có thể là potassium chloride; chất B có thể là methanol.
Vận dụng trang 44 KHTN lớp 7
Khi cơ thể bị mất nước do tiêu chảy, nôn mửa, …người ta thường cho bệnh nhân uống dung dịch oresol. Tìm hiểu qua sách báo và internet, hãy cho biết thành phần của oresol có các loại chất nào (chất ion, chất cộng hóa trị)?
Trong trường hợp không có oresol thì có thể thay thế bằng cách nào khác không? Giải thích.
Trả lời:
Thành phần chính của oresol:
- Các hợp chất ion: Sodium chloride (NaCl); potassium chloride…
- Hợp chất cộng hóa trị: glucose.
 Một số loại oresol
Một số loại oresol
Công dụng chính của osresol là bổ sung nước và các chất điện giải cho cơ thể.
Trong trường hợp không có oresol thì có thể thay thế bằng:
- Nước muối đường: Có thành phần tương tự như oresol. Pha theo tỷ lệ 1 thìa cà phê muối, 8 thìa đường và 1 lít nước.
- Nước cháo muối (1,2 lít nước, 1 thìa muối, 1 nắm gạo), đồng thời uống bổ sung nước dừa, nước cam, ăn thêm chuối để bổ sung thêm potassium.
BÀI TẬP SÁCH GIÁO KHOA
Bài 1 trang 44 KHTN lớp 7
Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết trong phân tử sodium oxide (hình bên).
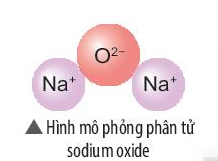
Trả lời:
Sự tạo thành liên kết trong phân tử sodium oxide (Na2O).
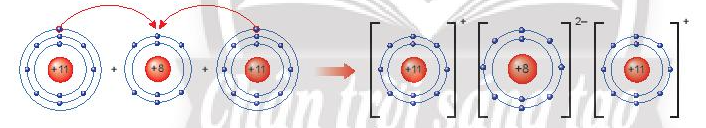
Bài 2 trang 44 KHTN lớp 7
Cho biết vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O và vẽ sơ đồ hình thành liên kết trong các phân tử ở hình sau:
Trả lời:
Vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O được xác định theo bảng sau:
Nguyên tố | Vị trí các nguyên tố trong bảng tuần hoàn | Số electron lớp ngoài cùng |
N | Ô thứ 7, chu kì 2, nhóm VA | 5 |
C | Ô thứ 6, chu kì 2, nhóm IVA | 4 |
O | Ô thứ 8, chu kì 2, nhóm VIA | 6 |
Sự tạo thành liên kết trong phân tử nitrogen:
+ Nguyên tử N có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
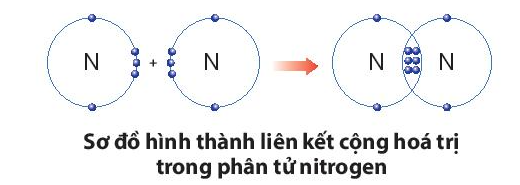
+ Nguyên tử C có 4 electron ở lớp ngoài cùng và cần thêm 4 electron để đạt được lớp vỏ bền vững tương tự khí hiếm Ne.
+ Trong phân tử khí carbon dioxide, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron. Như vậy, giữa nguyên tử C và O có hai đôi electron dùng chung theo sơ đồ sau:
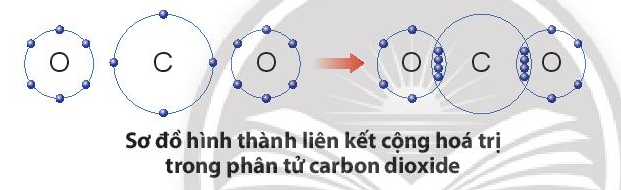
Bài 3 trang 44 KHTN lớp 7
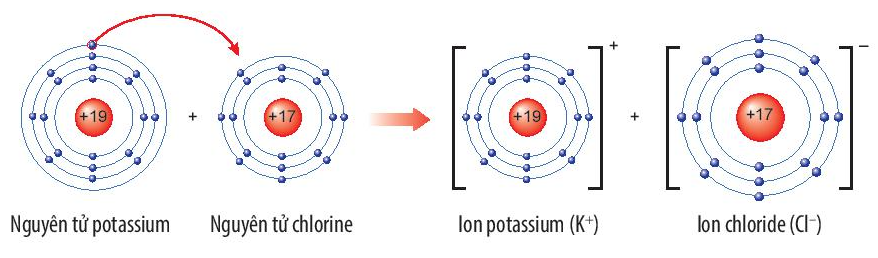
Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống. Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thận, cơ và cả hệ thần kinh.
Hợp chất potassium chloride có loại liên kết gì trong phân tử? Vẽ sơ đồ hình thành liên kết có trong phân tử này.

Trả lời:
Hợp chất potassium chloride (KCl) có liên kết ion trong phân tử.
Sự hình thành liên kết trong phân tử potassium chloride
+ Nguyên tử K nhường đi 1 electron ở lớp ngoài cùng trở thành ion potassium, mang điện tích dương, kí hiệu là K+.
+ Nguyên tử Cl nhận 1 electron từ nguyên tử K trở thành ion chloride, mang điện tích âm, kí hiệu là Cl-.
Các ion K+ và Cl- hút nhau tạo thành liên kết trong phân tử potassium chloride.
SÁCH BÀI TẬP
Bài 6.1 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Tất các các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng.
B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron.
C. Các nguyên tố khí hiếm đều rất khó hoặc không kết hợp với nguyên tố khác thành hợp chất.
D. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí.
Lời giải:
Đáp án đúng là: C
A sai vì He là khí hiếm chỉ có 2 electron ở lớp ngoài cùng.
B sai vì số lớp electron của các khí hiếm là khác nhau.
D sai vì khí hiếm gần như không kết hợp với các nguyên tố khác tạo hợp chất.
Bài 6.2 trang 18 SBT Khoa học tự nhiên 7: Hãy chọn phát biểu đúng để hoàn thành câu sau: Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của nguyên tố có khuynh hướng
A. nhường các electron ở lớp ngoài cùng.
B. nhận thêm electron vào lớp electron ngoài cùng.
C. nhường electron hoặc nhận electron để lớp electron ngoài cùng đạt trạng thái bền (có 8 electron).
D. nhường electron hoặc nhận electron hoặc góp chung electron.
Lời giải:
Đáp án đúng là: D
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của nguyên tố có khuynh hướng nhường electron hoặc nhận electron hoặc góp chung electron.
Bài 6.3 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
B. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
C. Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
D. Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Lời giải:
Đáp án đúng là: D
Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
A, B sai vì nguyên tử của nguyên tố phi kim không tạo ion dương.
C sai vì nguyên tử của nguyên tố kim loại chỉ nhường electron.
Bài 6.4 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Nguyên tố tạo ion âm đều là nguyên tố phi kim.
B. Nguyên tố tạo ion dương có thể là nguyên tố kim loại hoặc nguyên tố phi kim.
C. Để tạo ion dương thì nguyên tố phi kim sẽ nhường electron.
D. Để tạo ion âm thì nguyên tố kim loại sẽ nhận electron.
Lời giải:
Đáp án đúng là: A
B sai vì nguyên tố kim loại không tạo ion âm.
C sai vì nguyên tố phi kim không nhường electron.
D sai vì nguyên tố kim loại không nhận electron.
Bài 6.5 trang 18 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhường electron ở lớp ngoài cùng.
B. Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
C. Để tạo ion âm thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
D. Để tạo ion âm thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Lời giải:
Đáp án đúng là: B
A sai vì nguyên tố phi kim nhận electron.
C sai vì nguyên tố kim loại không nhận thêm electron.
D sai vì nguyên tử của nguyên tố hóa học nhường electron sẽ tạo thành ion dương.
Bài 6.6 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Liên kết trong các phân tử đơn chất thường là liên kết cộng hóa trị.
B. Sau khi các nguyên tử liên kết với nhau, số electron ở lớp ngoài cùng sẽ giống nguyên tố khí hiếm.
C. Liên kết giữa các nguyên tố phi kim thường là liên kết cộng hóa trị.
D. Liên kết giữa các nguyên tố kim loại với nguyên tố phi kim đều là liên kết ion.
Lời giải:
Đáp án đúng là: D
D sai vì có một số trường hợp đặc biệt liên kết giữa nguyên tố kim loại với nguyên tố phi kim là liên kết cộng hóa trị vú dụ AlCl3.
Bài 6.7 trang 19 SBT Khoa học tự nhiên 7: Ở điều kiện thường, phát biểu nào sau đây là đúng?
A. Tất cả các hợp chất ở thể rắn đều là chất ion.
B. Chất cộng hóa trị luôn ở thể rắn.
C. Chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị và luôn ở thể khí.
D. Hợp chất có chứa kim loại thường là chất ion.
Lời giải:
Đáp án đúng là: D
A sai vì hợp chất cộng hóa trị cũng ở thể rắn, ví dụ đường, iodine…
B, C sai vì hợp chất cộng hóa trị có thể ở thể rắn, thể lỏng hoặc thể khí.
Bài 6.8 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây không đúng?
A. Hợp chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị.
B. Hợp chất chỉ có liên kết ion là chất ion.
C. Một số hợp chất có cả liên kết ion và liên kết cộng hóa trị.
D. Ở điều kiện thường, hợp chất ở thể rắn là chất ion.
Lời giải:
Đáp án đúng là: D
Đáp án D không đúng, vì hợp chất ở thể rắn có thể là chất cộng hóa trị (đường, paraffin, …)
Bài 6.9 trang 19 SBT Khoa học tự nhiên 7: Phát biểu nào sau đây đúng?
A. Hợp chất ion và chất cộng hóa trị đều bền với nhiệt.
B. Hợp chất ion và chất cộng hóa trị đều tan tốt trong nước.
C. Khi các chất ion và chất cộng hóa trị tan trong nước đều tạo dung dịch có khả năng dẫn điện được.
D. Các chất ion luôn ở thể rắn.
Lời giải:
Đáp án đúng là: D
A sai vì một số hợp chất cộng hóa trị kém bền với nhiệt.
B sai vì nhiều hợp chất khó tan hoặc không tan trong nước.
C sai vì có hợp chất tan trong nước tạo dung dịch không có khả năng dẫn điện.
Bài 6.10 trang 19 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
(a) Tất cả các chất ion đều ở thể rắn.
(b) Tất cả các chất ion đều tan trong nước và tạo thành dung dịch có khả năng dẫn điện.
(c) Khi đun sodium chloride rắn ở nhiệt độ cao sẽ được sodium chloride lỏng, dẫn điện.
(d) Đường tinh luyện và muối ăn đều là chất rắn tan được trong nước tạo dung dịch dẫn điện.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: C
(d) sai vì dung dịch nước đường không dẫn điện.
Bài 6.11 trang 20 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
a) Ở điều kiện thường, các chất ion đều ở thể rắn.
b) Ở điều kiện thường, các hợp chất ở thể lỏng đều là chất cộng hóa trị.
c) Hợp chất của kim loại khó bay hơi, khó nóng chảy, dễ tan trong nước tạo thành dung dịch dẫn được điện.
d) Hợp chất chỉ gồm các nguyên tố phi kim thường dễ bay hơi, kém bền với nhiệt.
e) Hợp chất tan được trong nước thành dung dịch không dẫn điện thường là chất cộng hóa trị.
Số phát biểu đúng là
A. 5.
B. 4.
C. 3.
D. 2.
Lời giải:
Cả 5 phát biểu đều đúng.
Bài 6.12 trang 20 SBT Khoa học tự nhiên 7: Có các phát biểu sau:
a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
b) Để có 8 electron ở lớp vỏ ngoài cùng thì nguyên tử aluminium hoặc nhường 3 electron hoặc nhận 5 electron.
c) Liên kết trong hợp chất tạo bởi magnesium và chlorine là liên kết ion.
d) Trong phân tử, hợp chất gồm các nguyên tố C, H, O chỉ có liên kết cộng hóa trị.
e) Khi tạo liên kết hóa học, nguyên tử chlorine chỉ tạo ion âm bằng cách nhận thêm 1 electron.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: B
Các phát biểu đúng là (c); (d).
Bài 6.13 trang 20 SBT Khoa học tự nhiên 7: Điền đầy đủ các từ hoặc cụm từ thích hợp vào các câu dưới đây:
a) Để tạo ion dương thì (1) …. sẽ (2) ….. Số electron (3) …. bằng (4) ….
b) Để tạo ion âm thì (5) … sẽ (6) …. Số electron (7) … bằng (8) ….
Lời giải:
a) Để tạo ion dương thì (1) kim loại sẽ (2) nhường electron. Số electron (3) nhường bằng (4) số electron lớp ngoài cùng.
b) Để tạo ion âm thì (5) phi kim sẽ (6) nhận electron. Số electron (7) nhận bằng (8) 8 – số electron lớp ngoài cũng.
Bài 6.14 trang 20 SBT Khoa học tự nhiên 7: Điền đẩy đủ các từ hoặc cụm từ thích hợp vào các câu dưới đây:
a) Chất ion luôn chứa nguyên tố (1)…., ở điều kiện thường luôn ở (2)…
b) Ở điều kiện thường, chất ở thể khí luôn là (3)… Chất này có thể (4)…., tạo dung dịch có khả năng (5)…
Lời giải:
a) Chất ion luôn chứa nguyên tố (1) kim loại, ở điều kiện thường luôn ở (2) thể rắn.
b) Ở điều kiện thường, chất ở thể khí luôn là (3) chất cộng hóa trị. Chất này có thể (4) tan được trong nước, tạo dung dịch có khả năng (5) dẫn điện hoặc không dẫn điện.
Bài 6.15 trang 20 SBT Khoa học tự nhiên 7: Magnesium oxide (gồm 1 nguyên tử magnesium và 1 nguyên tử oxygen) có nhiều ứng dụng trong đời sống. Nó là thành phần chính trong các lò sản xuất sắt, thép, các loại kim loại màu, thủy tinh hay xi măng, … Em hãy cho biết thêm các ứng dụng khác của magnesium oxide. Vẽ sơ đồ hình thành liên kết tạo ra phân tử magnesium oxide và tính khối lượng phân tử của nó.

Lời giải:
- Các ứng dụng khác của magnesium oxide: Xử lí đất, nước ngầm, xử lí nước thải, xử lí nước uống bằng cách ổn định độ pH. Magnesium oxide còn được sử dụng làm thuốc dịu cơn đau, ợ nóng và chua của chứng đau dạ dày, khó tiêu, ổn định tính acid của dạ dày,…
- Sơ đồ hình thành liên kết tạo ra phân tử magnesium oxide:
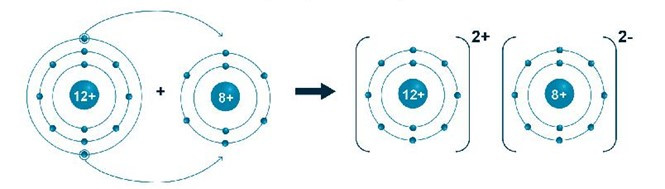
- Khối lượng phân tử magnesium oxide = 24 + 16 = 40 (amu).
Bài 6.16 trang 21 SBT Khoa học tự nhiên 7: Hãy liệt kê 2 chất khó bay hơi, khó nóng chảy, dễ tan trong nước tạo dung dịch dẫn được điện.
Lời giải:
Chất khó bay hơi, khó nóng chảy, dễ tan trong nước tạo dung dịch dẫn được điện là chất ion.
Ví dụ hai chất có tính chất trên là:
+ Muối ăn (sodium chloride, NaCl) gồm 1 nguyên tử Na và 1 nguyên tử Cl.
+ Calcium chloride (CaCl2) gồm 1 nguyên tử Ca và 2 nguyên tử Cl.
Bài 6.17 trang 21 SBT Khoa học tự nhiên 7: Trong giấm gạo có chứa từ 7% đến 20% acetic acid (phân tử gồm 2 nguyên tử carbon, 4 nguyên tử hydrogen và 2 nguyên tử oxygen). Theo em, acetic acid là chất ion hay chất công hóa trị? Tính khối lượng phân tử của hợp chất này.

Lời giải:
Phân tử acetic acid là chất cộng hóa trị do phân tử gồm các nguyên tố phi kim, điều kiện thường ở thể lỏng.
Khối lượng phân tử acetic acid là: 12 . 2 + 1 . 4 + 16 . 2 = 60 (amu).
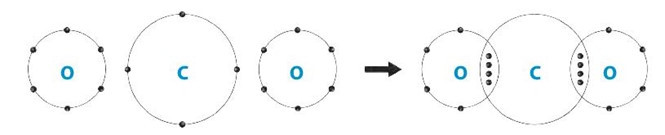
Bài 6.18 trang 21 SBT Khoa học tự nhiên 7: Phân tử (A) có khối lượng phân tử > 30 amu, thể khí, là nguyên nhân gây ra hiệu ứng nhà kính. Trong phân tử (A) có loại liên kết gì? Vẽ sơ đồ hình thành liên kết trong phân tử (A).
Lời giải:
Chất (A) có khối lượng phân tử > 30 amu, thể khí, là nguyên nhân gây ra hiệu ứng nhà kính vậy (A) là carbon dioxide.
Carbon dioxide thể khí, được tạo thành từ các nguyên tử phi kim liên kết trong phân tử carbon dioxide là liên kết cộng hóa trị.
Sơ đồ hình thành liên kết trong phân tử carbon dioxide:
Bài 6.19 trang 21 SBT Khoa học tự nhiên 7: Hãy liệt kê 3 phân tử đều tạo từ một nguyên tố T và đều có khối lượng phân tử nhỏ hơn 50 amu. Trong đó gồm: 1 phân tử đơn chất, 1 phân tử hợp chất có chứa liên kết ion và 1 phân tử hợp chất có chứa liên kết cộng hóa trị. Tính khối lượng các phân tử trên.
Lời giải:
Nguyên tố T là oxygen.
+ Phân tử đơn chất là khí oxygen (gồm 2 nguyên tử oxygen), khối lượng phân tử là:
16 . 2 = 32 (amu).
+ Phân tử hợp chất có liên kết ion là magnesium oxide (gồm 1 nguyên tử Mg và 1 nguyên tử O), khối lượng phân tử là: 24 + 16 = 40 (amu).
+ Phân tử hợp chất có liên kết cộng hóa trị là carbon dioxide (gồm 1 nguyên tử C và 2 nguyên tử O), khối lượng phân tử là: 12 + 16 . 2 = 44 (amu).
Bài 6.20 trang 21 SBT Khoa học tự nhiên 7: Trong quả nho chín có chứa nhiều glucose. Phân tử glucose gồm có 6 nguyên tử carbon, 12 nguyên tử hydrogen và 6 nguyên tử oxygen. Theo em, trong phân tử glucose có liên kết ion hay liên kết cộng hóa trị? Giải thích và tính khối lượng phân tử glucose.

Lời giải:
Các nguyên tố trong phân tử glucose chỉ gồm các nguyên tố phi kim nên trong phân tử glucose chỉ có liên kết cộng hóa trị.
Khối lượng phân tử: 12 . 6 + 1 . 12 + 16 . 6 = 180 (amu).
Bài 6.21 trang 21 SBT Khoa học tự nhiên 7: Hợp chất (B) có trong “muối i - ốt” được sử dụng trong thuốc điều trị bệnh cường giáp, nấm da và dùng làm thực phẩm chức năng, … Vậy, (B) là hợp chất ion hay hợp chất cộng hóa trị? Cho biết khối lượng phân tử của (B).
Lời giải:
(B) là potassium iodide. Trong phân tử (B) có liên kết ion nên (B) là hợp chất ion.
Phân tử (B) gồm 1 nguyên tử K (potassium) và 1 nguyên tử I (iodine).
Khối lượng phân tử (B) là: 39 + 127 = 166 (amu).
Bài 6.22 trang 21 SBT Khoa học tự nhiên 7: Để pháo hoa có nhiều màu sắc khác nhau, người ta sẽ cho vào thuốc pháo các chất phụ gia tạo màu. Các chất phụ gia này thường là muối của một số kim loại, trong đó có muối (D) gồm 1 nguyên tử kim loại M và một nguyên tử Cl; biết (D) có khối lượng phân tử là 135 amu. Tra bảng tuần hoàn, hãy xác định kim loại M. Trong phân tử muối (D) có loại liên kết gì? Giải thích.

Lời giải:
Khối lượng phân tử (D) = khối lượng nguyên tử (M) + x. khối lượng nguyên tử (Cl)
Với x là số nguyên tử Cl.
Thay số vào ta được: 135 = khối lượng nguyên tử (M) + x . 35,5
+ Với x = 1, khối lượng nguyên tử (M) = 99,5 amu (loại)
+ Với x = 2, khối lượng nguyên tử (M) = 64 amu (thỏa mãn).
Vậy M là Cu.
Vì phân tử (D) chứa Cu và Cl nên trong phân tử (D) có liên kết ion.